三阴性乳腺癌(TNBC)作为乳腺癌中最具侵袭性的亚型,因其缺乏特异性治疗靶点、化疗应答率低及免疫原性差,导致临床预后极差,复发率和转移倾向高。传统的治疗方法如化疗和放疗虽有一定疗效,但受限于全身毒性和耐药性问题,难以显著改善患者预后。近年来,铁死亡(Ferroptosis)作为一种新发现的受调控细胞死亡形式,因其依赖铁离子介导的脂质过氧化反应,在TNBC治疗中展现出巨大潜力。然而,如何有效诱导铁死亡并克服肿瘤微环境中的氧化抵抗,仍是亟待解决的科学难题。
2025年8月重庆医科大学基础医学院联合重庆市中医院团队在生物医学1区杂志《Theranostics》(IF:13.3)上发表了题为Injectable SF-platform orchestrates GPX4-targeted ferroptosis-autophagy-immunogenic circuit for overcoming oxidative resistance in triple-negative breast cancer的研究文章。研究团队创新性地提出“局部GPX4抑制剂”概念,构建了一种可注射磁性温敏丝素蛋白水凝胶平台(IMSFs),结合时序控制的TAT-Beclin1多肽递送系统,旨在通过局部诱导铁死亡、协同自噬与免疫激活,构建一个自我放大的“铁死亡-自噬-免疫”级联回路,从而实现高效、低毒的TNBC治疗。

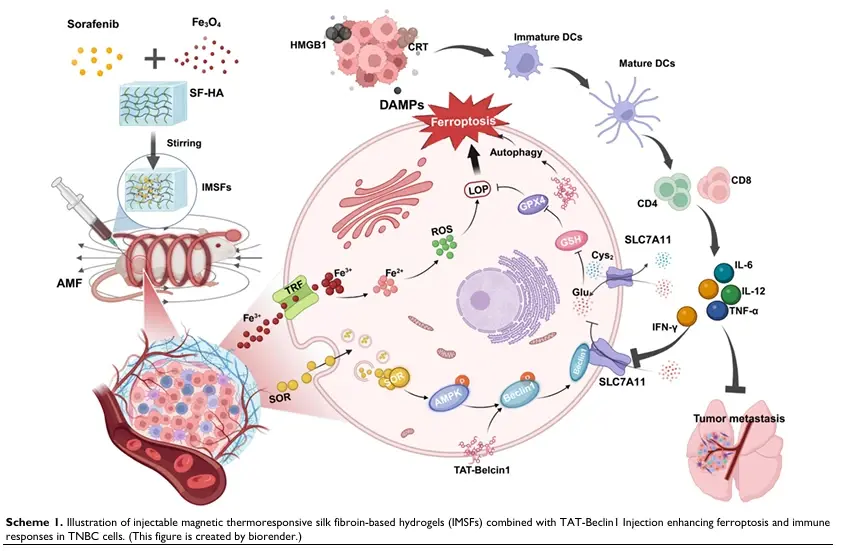
IMSFs平台的构建与表征
研究团队采用两步法合成了含有磁性纳米粒子(Fe₃O₄)和索拉非尼(Sorafenib,SOR)的丝素蛋白-透明质酸(SF-HA)复合水凝胶,即IMSFs。该水凝胶通过蛋白质-多糖相互作用形成生物模拟细胞外基质支架,具有良好的结构稳定性和生物相容性。通过扫描电子显微镜(SEM)、能谱分析(EDS)等手段对IMSFs的形貌和元素分布进行了表征,结果显示Fe₃O₄和SOR粒子在水凝胶中均匀分布。此外,IMSFs还表现出良好的磁热响应性和药物控释性能,能够在交变磁场(AMF)作用下实现局部温和热疗(42-45°C)和药物释放。
铁死亡诱导机制的探索
研究团队通过定量PCR、Western blot和免疫共沉淀等技术,深入探讨了IMSFs平台诱导铁死亡的分子机制。结果显示,在AMF作用下,IMSFs通过释放Fe²⁺/Fe³⁺离子催化Fenton反应,生成大量活性氧(ROS),同时释放SOR抑制系统Xc⁻/GSH/GPX4抗氧化通路,导致细胞内脂质过氧化物积累,从而触发铁死亡。特别是,SOR通过激活AMPK-Beclin1-SLC7A11轴,抑制SLC7A11表达,进一步削弱GPX4的抗氧化能力,加剧铁死亡进程。
自噬与铁死亡的协同作用
为了放大铁死亡的疗效,研究团队创新性地引入了TAT-Beclin1多肽,通过时序控制的方式,在IMSFs诱导铁死亡后增强自噬。自噬的激活不仅没有削弱铁死亡,反而通过增强脂质过氧化物的降解和免疫原性细胞死亡(ICD)的触发,放大了铁死亡的抗肿瘤效果。这一发现挑战了传统观念,即自噬通常被视为一种细胞保护机制,可能抑制铁死亡。研究表明,在特定条件下,自噬与铁死亡可以协同作用,共同促进肿瘤细胞的死亡。
免疫激活与抗肿瘤效果评估
研究团队通过体内外实验评估了IMSFs平台结合TAT-Beclin1治疗对TNBC的免疫激活和抗肿瘤效果。结果显示,该治疗方案显著增加了肿瘤内CD8+T细胞的浸润,促进了树突状细胞(DCs)的成熟和活化,并触发了强烈的免疫应答。此外,该治疗方案还显著抑制了肿瘤生长和肺转移,提高了小鼠的生存率。这些结果表明,IMSFs平台结合TAT-Beclin1治疗能够通过诱导铁死亡和自噬,激活机体免疫系统,实现对TNBC的高效低毒治疗。
总结:本研究通过构建可注射磁性温敏丝素蛋白水凝胶平台(IMSFs),结合时序控制的TAT-Beclin1多肽递送系统,成功诱导了TNBC细胞中的铁死亡和自噬,并激活了机体的免疫系统。这一创新策略不仅提高了治疗效果,还降低了全身毒性,为TNBC的治疗提供了新的思路和方法。未来研究可以进一步探索IMSFs平台在其他类型肿瘤治疗中的应用潜力,并优化治疗方案以提高患者的生存率和生活质量。同时,深入研究铁死亡与自噬的协同作用机制以及免疫激活的具体途径,将有助于开发更加精准和有效的抗肿瘤治疗策略。










